Wie unter alten Kriegsveteranen, ist es auch bei Chemikern, wenn sie beisammensitzen nicht unüblich in der Vergangenheit zu schwelgen und Annekdoten und „Kriegsgeschichten“ aus der Laborausbildung während des Studiums auszutauschen. Und so kam mir gestern, als ich mit einem Kollgen bei einem Eis in der Sonne saß folgende Geschichte wieder in den Sinn:

Ein Studienkollege pflegte mal zu sagen: “Ich bin organischer Chemiker ! Ich kann machen, dass Luft stinkt” In der Tat hat die organische Chemie eine Mannigfaltigkeit von Gerüchen – vom himmlischen Wohlgeruch bis zum übelsten Höllenodem – im Repertoir.
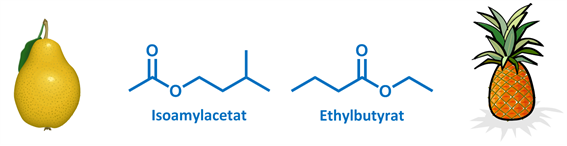
Schon die Praktikanten im chemischen Nebenfachpraktikum stellen Birnenester her (oder auf chemisch: iso-Amylacetat), dessen Geruch irgendwo zwischen extrem künstlichen Birnenaroma marke Fruchtzwerg und Eisbonbons angesiedelt ist. Auch beliebt: Ethylbutyrat… Riecht fast authentisch nach Ananas. Doch entfernen sie mal den Alkohol aus den Estern… Was übrig bleibt riecht nicht mehr lecker. Spaltet man das Ethylbutyrat, erhält man Ethylalkohol (geruchlich ja ganz ok) und eben Buttersäure, welche unsere olfaktorischen Rezeptoren mit dem Aroma von frisch Erbrochenen umschmeichelt. Einen Kohlenstoff wenig und wir erhalten Propionsäure… Eine tragende Geruchskomponente von überreifem Käse und Schweißfüßen. Nicht schön, aber noch harmlos.
Ein Hauch von Schwefel liegt in der Luft
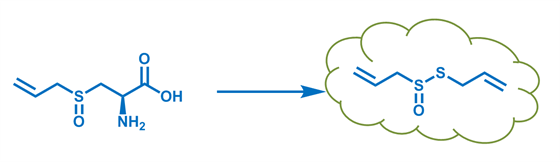
Mehr Bumms hat da schon die Schwefelchemie. Ein Umstand, der selbst einem Chemie-Laien bekannt sein dürfte… Knoblauch… Zwiebel… Alles Düfte, die sich der Macht des Schwefels bedienen. Ein Geschickter Kunstgriff von Mutter Natur um sich Fraßfeinde vom Leibe zu halten. Sobald man Knobi und Zwiebel mit Zähnen oder Messer zu Leibe rückt, wird eine geruchslose, aber dennoch schwefelhaltige, Aminosäure gespalten und es entsteht ein Aroma, dass einem die Tränen in die Augen treibt.
Glücklicherweise habe ich beruflich nur noch wenig mit Schwefelchemie zu tun. Doch als Praktikant hatte ich mal das zweifelhafte Vergnügen ein Sulfid als Liganden für einen Metallkomplex basteln zu dürfen. Für den Laien: Sulfide sind Stoffe, die sich vom Schwefelwasserstoff, einem Fäulnisgas mit dem Geruch von faulen Eiern, ableitet und die Aromapalette von gekochtem Kohl, faulen Eiern und Knoblauch abdecken.
Trotz höchster Vorsicht und Benutzens zweier Lagen Handschuhe damals, haben meine Hände intensiv nach zu lange gekochtem Kohl gestunken. Konsequenz: Wo man hinkommt, wird sofort ein Platz frei und die eigene Freundin verweigert einem den Begrüßungskuss und verbannt einen auf das Sofa am anderen Ende des Raums. Ja, Schwefelchemie kann einsam machen.

Vielleicht hat es deswegen auch fast 100 Jahre gedauert, bis die Inhaltsstoffe des Stinktiersekrets vollständig analysiert waren: Kaum hatte sich ein wagemutiger und vermutlich auch schwer verschnupfter Chemiker daran gegeben, die Emissionen des Stinktiers genauer unter die Lupe zu nehmen, kam es nicht selten vor, dass dieser von seinem beruflichen Umfeld (teilweise unter Gewaltandrohung) dazu genötigt wurde, dieses übelriechende Projekt wieder zu stoppen.
Schlimmer geht immer…
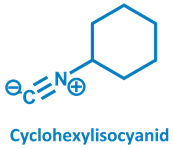
Die absolute Pole-Position in der Kategorie Superstinker (zumindest in meinen Augen) belegt aber eine ganz andere Geruchsnote. Isocyanide… Die ungeliebten Geschwister der Cyanide (Derivate der Blausäure, giftig aber von erträglichem Geruch). Schwer zu beschreiben wonach Isocyanide riechen… Ein absolut durchdringender, fremdartiger und ultimativ widerwärtiger Gestank. Cyclohexylisocyanid… Das war das einzige Mal, dass ich wegen eines Geruchs das Labor fluchtartig verlassen musste, weil ich sonst in den Abzug gekotzt hätte. Guter Grund also diesen Mief zu meiden und jegliche Arbeit damit kategorisch zu verweigern. Sehr zu meinem Leidwesen holte mich der Superstinker jedoch wieder ein: Während meiner PostDoc Zeit musste ausgerechnet mein direkter Labornachbar diese Stinkbombe zu seinem Lieblingsreagenz machen, wodurch mir sicherlich so manche ungeplante Kaffeepause beschert wurde, um die Zeit auszusitzen bis das Isocyanid sich wieder verduftet hatte.
Und meine Abneigung ist sicherlich nicht unbegründet: So schreibt ein Geruchs- und Aromaexperte darüber folgendes:
[Isonitriles] are just the Godzilla of smells, you can’t believe how awful they smell, they make you vomit your guts out instantly.
aus: C. Burr, The Emperor of Scent: A Story of Perfume, Obsession, and the Last Mystery of the Senses
Wir sehen also, nichts womit man sich bei seinen lieben Labornachbarn Freunde macht. Kein Wunder, dass manche Leute es deswegen vorziehen, dieses Teufelszeug Sonntags zu destillieren, wenn sonst niemand im Labor ist. Noch drastischer werden die olfaktorischen Qualitäten dieser Superstinker von Davis und Yelland schon im Jahre 1937 beschrieben:
n-Butyl isocyanide proved to be so disagreeable to manipulate that none of its physical constants except boiling point were determined. Even when a hood with an extra forced draft was used, the odor pervaded the laboratory and adjoining rooms, deadening the sense of smell and producing in the operator, and in others, severe headaches and nausea which usually persisted for several days.
— Davis & Yelland J. Am. Chem. Soc. 1937, 59, 1998.
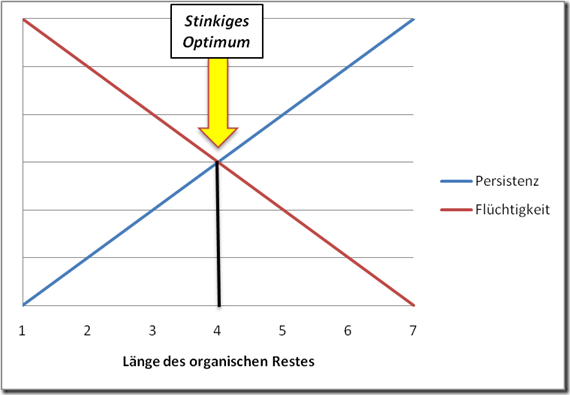
n-Butyl, eine Kette von vier Kohlenstoffen, das scheint eine ideale Grundlage in Sachen Gestank zu sein. Denn neben dem üblen Aroma, macht erst ein entsprechendes Ausbreitungsverhalten aus einem üblen Geruch einen wahren Superstinker. Eine infernalische Geruchsnote wird erst richtig heimtückisch, wenn diese über ein optimales Verhältnis von Flüchtigkeit und Persistenz verfügt. Kleine organische Moleküle sind leicht flüchtig… Bedeutet: Werden sie freigesetzt, verbreiten sie sich relativ schnell und verpesten die ganze Umgebung, oder in anderen Worten: ein Tropfen und die ganze Bude stinkt. Das hat allerdings auch Vorteile… Nach kurzem, aber intensivem Gestank, bleibt dieser nicht lange bestehen, weil er relativ schnell verfliegt. Größere Moleküle haben hingegen die umgekehrte Eigenschaft: Sie verdunsten zwar nicht so schnell und sind nur in der direkten Nachbarschaft der Quelle intensiv zu riechen, sind aber ziemlich hartnäckig, so dass man recht lange noch „Freude“ an ihnen hat. Hat man sie einmal in der Nase, wird man den Geruch auch bei reichlicher Frischluftzufuhr nicht so schnell wieder los. Hier besitzt der Butylrest (C4) das beste von beiden Eigenschaften… Flüchtig genug um zu stinken wie ein ganz Großer und in dieser Eigenschaft sehr ausdauernd.