Kommen wir mal wieder zur Chemie. Und zwar einem Aspekt der Chemie ohne den unser Alltag um einiges trister und im wörtlichen Sinn grau wäre: Farben !
Von den Buntstiften unseres Nachwuchses, über den Lack auf unserem Auto, der der Bemalung der Porzellantasse aus der wir jeden Morgen unseren Kaffee schlürfen, bis hin zu Farbstoff im Essen (weniger schön, wenn dieser synthetisch und künstlich zugesetzt ist). „Doch Halt !“, mag das da Mancher argumentieren, „Sind nicht auch die Blumen auf der Wiese oder z.B. die Flügel des Schmetterlings schön bunt und farbenfroh?“. „Völlig richtig“, antwortet da der Chemiker, „aber wir wollen auch nicht vergessen, dass Mutter Natur eine sehr begabte Chemikerin ist !“.

Warum ist Farbe bunt ?
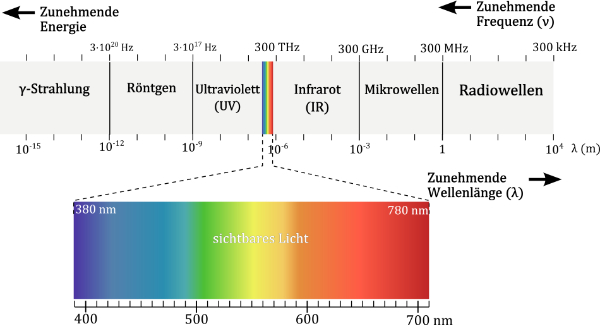
Alle Farbe steckt im Licht. Klingt erst einmal ziemlich esoterisch, aber im Dunkeln ist bestenfalls gut munkeln, aber ohne Licht sieht man nun mal nichts. Guckt man sich das Sonnenlicht an einem klaren Sommertag an, dann erscheint es farblos. Betrachtet man es jedoch durch ein Prisma, dann sieht man, dass das weiße Licht aus mehreren farbigen Komponenten zusammen gesetzt ist oder präziser ausgedrückt: das weiße Licht (polychromatisch = vielfarbig) ist eine Überlagerung von Licht mehrerer Wellenlängen. Licht einer einzigen Wellenlänge (monochromatisch), wie z.B. 450 nm ist zum Beispiel blau-violett, während solches mit der Wellenlänge 600 nm rot-orange ist.
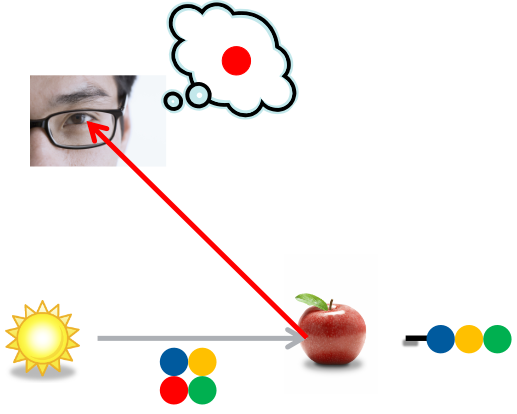
Kommen wir nun zu den Farbstoffen. Wir können einen Gegenstand sehen, wenn Licht auf ihn fällt und er dieses zu uns reflektiert. Werden alle Wellenlängen reflektiert, erscheint der Gegenstand weiß. Absorbiert der Gegenstand jedoch bestimmte Wellenlängen, d.h. entfernt er diese aus dem reflektierten Licht, nehmen wir ihn als farbig wahr. Fällt das Licht z.B. auf einen roten Apfel, schluckt dieser die blauen und grünen Anteile und wir sehen die Farbe Rot, also die Komplementärfarbe zu Blau-Grün. In der Regel ist dieses rote Licht aber trotzdem nicht monochromatisch, sondern enthält immer noch eine Kombination zahlreicher Wellenlängen, erscheint uns aber aufgrund des Nichtvorhandenseins der Komplementärfarben trotzdem rot. Man spricht hier auch von subtraktiver Farbmischung, weil bestimmte Farben aus dem Licht abgezogen, sprich subtrahiert werden.
Jetzt wird’s physikalisch
Damit ein Stoff Licht absorbieren kann, benötigt er einen Chromophor (griechisch χρῶμα chrṓma ,Farbe‘, φορός phorós ‚tragend‘). Dies ist ein strukturelles Element mit delokalisierbaren pi-Elektronen, oder einfacher ausgedrückt mit „beweglichen“ Elektronen, die man durch Zuführung von Energie aus ihrem Grundzustand in ein energetisch angeregten Zustand heben kann. Je größer die Lücke zwischen diesen Zuständen ist, die überbrückt werden muss, desto mehr Energie in Form von Licht ist notwendig. Am energiereichsten ist blaues Licht (kurze Wellenlänge), während rotes Licht (große Wellenlänge) am anderen Ende der Energieskala liegt. Dabei wird immer nur die Wellenlänge absorbiert, deren Energie der Lücke zwischen den Zuständen des Chromophors entspricht. Ergo: Der Farbstoff absorbiert nur ganz bestimmte Wellenlängen aus dem polychromatischen Licht und es entsteht ein ganz bestimmter Farbeindruck. Besonders ausgedehnt ist der Chromophor im Graphit, welches eine Blätterteig-artige Struktur aus mehreren Lagen eines aus Benzolringen aufgebauten Wabenmusters ist. Hier sind die Elektronen besonders stark delokalisiert, weswegen ein sehr breites Spektrum an Wellenlängen absorbiert wird. Graphit ist deswegen schwarz.
Natürlich behält das angeregte Elektron nicht die Energie, sondern gibt diese nach kurzer Zeit wieder ab (ansonsten wäre die Fähigkeit zur Absorption irgendwann erschöpft und unser Farbstoff irgendwann nicht mehr farbig). Die Energie wird in den meisten Fällen in Wärme umgewandelt, kann bei besonderen Farbstoffen aber auch auf anderen Wegen, z.B. durch Aussenden von farbigem Licht wieder abgegeben werden. Dies kennen wir z.B. von Banknoten, die wenn wir sie mit UV-Licht bestrahlen fluoreszieren oder von den beliebten Leuchtsternen, die, einmal mit Licht „aufgeladen“ gelb-grün an der Kinderzimmerdecke leuchten (Phosphoreszenz).
Tintenblau und weißer Killer
Bleiben wir bei organischen Farbstoffen und dort bei einem besonders bekannten Beispiel: der blauen Tinte aus dem Füllfederhalter, die vermutlich jeder einmal beim Schreibenlernen in der Grundschule benutzt hat (bevor man später zu Kuli und/oder Finelinerstiften umgestiegen ist). Hier kommt z.B. der Farbstoff Wasserblau zum Einsatz, der nicht nur schön blau und relativ ungiftig ist, sondern auch wasserlöslich.
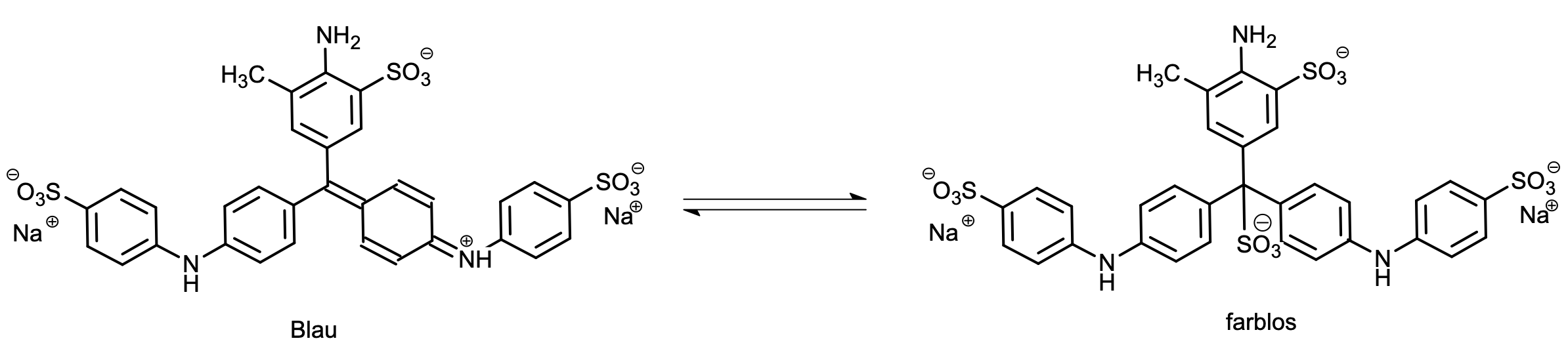
Sehr zur Freude vieler Grundschüler besitzen nun dieser Triphenylmethan-Farbstoff den Vorzug, dass man ihn mit einem Tintenkiller bearbeiten kann, wodurch das Geschriebene unsichtbar wird. Hässliche Tintenkleckse und Schreibfehler können so diskret kaschiert werden.
Diese bereits im Kaiserreich unter dem Namen Radierwasser auf den Markt gekommenen Präparate funktionieren dadurch, dass an das zentrale Kohlenstoffatom eine OH-Gruppe oder eine Sulfitgruppe angelagert wird, wodurch die für den Chromophor notwendige Kette von Doppelbindungen unterbrochen wird und der Farbstoff farblos wird.
Doch Obacht ! Das Geschriebene verschwindet nicht, sondern wird nur unsichtbar ! So lässt sich das vermeintlich Gelöschte durch Salzsäure- oder Essigdampf, sprich durch Einwirkung einer Säure wieder zum Vorschein bringen, indem der ursprüngliche Farbstoff regeneriert wird. Auch ein jahrelanges Liegen an Luft kann durch Oxidation die Schrift zumindest teilweise wieder sichtbar machen.
Dies geht natürlich nicht nur mit blauer Tinte: Prinzipiell geht dies auch mit anderen geeigneten Triphenylmethan-Farbstoffen. Ein Beispiel, dass ich aus eigener Anschauung aus meiner Kindheit her kenne sind die Malmäuse und der Löschkater:

Elf farbige Filzstiftmäuse, die von ihrem Antagonisten dem weißen Löschkater getilgt werden. Leider betrachtete meine Mutter die enthaltenen Chemikalien mit einer gehörigen Portion Argwohn, weswegen der Löschkater, der faszinierendste Teil des Sets, leider unter Verschluss blieb.
Geheime Botschaften
Hier sind wir dann auch nicht mehr weit von Geheimtinten entfernt, also Tinten, die im getrockneten Zustand farblos sind und erst durch Behandlung mit einem Reagenz wieder sichtbar werden. Nimmt man zum Beispiel die farblose Form des pH-Indikators Phenolphthalein zum Schreiben und bedampft das Schriftstück später mit Ammoniak, tritt die Schrift violett hervor. Alternativ kann man auch seine Nachricht mit einer schwachen Säure auf Papier schreiben. Erwärmt man den Brief dann später, beginnt das Papier sich an der beschrifteten Stelle zu zersetzen und färbt sich braun. Ein beliebter Versuch für Kinder benutzt hierfür z.B. Zitronensaft und ein Bügeleisen.

Da sich solche Tinten ausgezeichnet für den diskreten Versand von pikanten Liebesbriefen eignen, bürgerte sich auch der Begriff „sympathetische Tinte“ (von griech. Sympatheia „Zuneigung“) ein. Der römische Dichter Ovid empfahl hierfür auch die Benutzung von Milch, die sich durch Bestäuben mit Ruß wieder sichtbar machen lassen sollte. Einen ähnlichen Verwendungszweck hatten sogenannte Damentinten: Hier war die Nachricht zunächst offen lesbar, verblasste aber mit der Zeit durch offenen Zutritt von Luft. Also ideal um dem Liebhaber zu schreiben, ohne für den Vormund oder den gehörnte Ehemann später verfängliche Schriftstücke zu hinterlassen. Also eine frühe Form des heute benutzten Snapchats.
Bunte Tinte ? Nicht für Jedermann !
Warum sich bei der Tinte letztendlich der Farbton Blau durchgesetzt hat, ist durch einfache Google-Recherche nicht ganz zu klären, wenn auch sich diverse Hinweise finden lassen. Erst einmal: Früher war Tinte eher braun bis schwarz. Synthetische Farbstoffe kamen erst in der zweiten Hälfte des 19. Jahrhunderts auf und begründeten den Aufstieg der chemischen Industrie. Davor beinhalteten Tintenrezepturen schwarzen Ruß und/oder ein Gemisch aus Eisen(II)sulfat und den Saft von Galläpfeln. Zunächst war eine solche Eisengallustinte eher von schwacher Farbe, aber sobald das Eisen vom Luftsauerstoff in die Oxidationsstufe III oxidiert wurde, bildete sich mit der Gallussäure aus den Galläpfeln ein schwarzer, unlöslicher und damit dokumentenechter Farbstoff. Nachteil: Bekleckerte Textilien lassen sich nur schwer reinigen und das saure Eisensalz zersetzt über längere Zeiträume das Papier. Um der Tinte aber etwas mehr Farbkraft zu verleihen, bevor sie völlig oxidiert ist, setzte man der Tinte später den synthetischen Farbstoff Methylenblau zu. Der Eisenanteil hat sich dann im alltäglichen Gebrauch verloren, die blaue Farbe ist geblieben.

Wenn ich mich an meine Schulzeit erinnere, war die Benutzung von blauer Tinte bei Klassenarbeiten streng vorgeschrieben. Eben um eine zweifelsfreie Unterscheidung von der Korrektur des Lehrers mit roter Tinte zu gewährleisten. Grün war wiederum nur dem Schuldirektor vorbehalten.
Vorbild ist hier wohl die Vorschrift zu Aktenvermerken in Bundesministerien1: Grün bleibt dem Minister vorbehalten, Parlamentarische Staatssekretäre benutzen violett, Staatssekretäre nehmen den Rotstift, Abteilungsleiter blau und deren Unterabteilungsleiter benutzen den Braunstift, wenn sie am Seitenrand einen Vermerk anbringen. Ordnung muss schließlich sein.
Ein weiterer Vorteil von blauer Tinte gegenüber schwarzer, der aber erst in modernen Zeiten zum Tragen kam: Durch die Farbe der Tinte kann man das Original leicht von schwarz-weißen Fotokopien unterscheiden. Wobei dieser Vorteil durch das Aufkommen von preisgünstigen Farbdruckern sicherlich auch mittlerweile überholt ist.
- Nachzulesen in Anlage 2 zu §13 Abs. 2 der Gemeinsamen Geschäftsordnung der Bundesministerien (GGO) ↩
